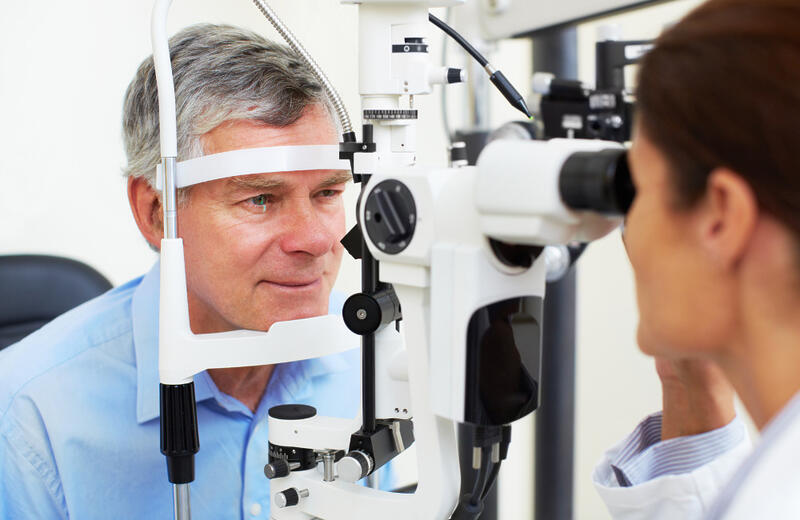
Pacientes que precisam de tratamentos oculares frequentes ganham uma nova alternativa terapêutica. A Anvisa aprovou a molécula faricimabe, produzida pela Roche.
O novo medicamento é indicado para o tratamento de duas doenças que podem levar a cegueira quando não tratadas corretamente:
- Degeneração macular relacionada à idade (DMRI) na forma úmida
- Edema macular diabético (EMD)
Ambas as doenças podem atingir a mácula, uma região no fundo do olho que é responsável pela formação da visão mais nítida e detalhada. O mecanismo de ação do medicamento fica a cargo de duas moléculas que atuam em vias distintas que comprometem a região em questão.
A aprovação da Anvisa foi baseada em estudos de fase 3 publicados no periódico Lancet, em que o faricimabe demonstrou eficácia e segurança para ambas as condições.
Com essa aprovação, o Brasil soma-se a mais de 50 países que já aprovaram a molécula, incluindo os Estados Unidos, o Japão e o Reino Unido.
Molécula aprovada pela Anvisa é opção para 1,4 mi de pacientes
Segundo dados da Clarivate Decisions Resources Group, 1,4 milhão de pessoas são atingidas por essas duas doenças no Brasil. Em todo o mundo, cerca de 40 milhões de pessoas são afetadas.
Juntas, a DMRI úmida e o EMD são as principais causas de perda de visão entre pessoas acima de 55 anos. O tratamento pode exigir injeções intravítreas (dentro do olho) até uma vez por mês.
Injeções intravítreas frequentes são desafio
Essa frequência elevada das injeções dentro do olho dificulta o tratamento. Em pesquisas realizadas no exterior, 54% dos entrevistados disse sentir ansiedade por mais de dois dias antes das aplicações.
Já aqui no Brasil, 40% dos pacientes com DMRI abandonaram o tratamento em algum momento, é o que afirma a associação Retina Brasil, em estudo realizado com o apoio da Roche.
Dentre as principais reclamações apresentadas pelos entrevistados estão:
- Alto número de injeções
- Ansiedade
- Desconforto
- Dor
- Irritação
- Medo de injeções
- Tempo de espera
“Reduzir a carga deste tipo de tratamento é muito importante para conseguirmos maior adesão e melhores resultados”, afirma o Dr. Caio Regatieri, professor do Departamento de Oftalmologia da Escola Paulista de Medicina (Unifesp).
“Estamos empolgados com a aprovação de um medicamento capaz de melhorar a qualidade de vida dos pacientes acometidos por essas doenças oftalmológicas, cujo manejo ainda é desafiador”, diz Michelle Fabiani, líder médica da Roche.
Fabiani ainda completa que, no último ano, o investimento em pesquisa clínica no Brasil cresceu. “Em 2022, investimos mais de R$ 440 milhões em pesquisa clínica no país, um aumento de mais de 30% em relação a 2021″, afirma.
Julho de inovação
No mês de julho, a Anvisa também aprovou um medicamento inovador para o controle do colesterol ruim (LDL) na forma injetável. A Inclisirana, da Novartis, é indicada para adultos com hipercolesterolemia primária (familiar heterozigótica ou não familiar) e dislipidemia mista.
Esse medicamento é destinado especialmente para pacientes de muito alto risco cardiovascular – ou seja, que já sofreram ataque cardíaco (infarto) ou derrame (AVC isquêmico).
“Manter o LDL controlado é essencial para que um paciente não volte a ter novos eventos cardiovasculares graves como esses, que têm mais chances de acontecerem depois de um primeiro caso”, explica Raul Santos, cardiologista do InCor-HCMFUSP, professor associado da Faculdade de Medicina da USP e ex-presidente da Sociedade Internacional de Aterosclerose (IAS).